Manejo terapéutico de la leishmaniosis desde el paciente seropositivo sano hasta aquel con enfermedad renal avanzada
patrocinado por:


Contenidos
Haz clic en los distintos apartados para ir al contenido
WhatsVet
Módulo: Tengo un seropositivo sano, ¿qué hago? patrocinado por Leisguard® de Ecuphar
Autoría: Anna Vila, LV, Dipl ECVIM, Servicio de Medicina Interna en Hospital Veterinario Universidad Católica de Valencia (UCV) y Xavier Roura, LV, PhD, Dipl ECVIM-CA, Hospital Clínic Veterinari Universitat Autònoma de Barcelona (UAB)
Podcasts
10 audiotips: ¿Siempre que tengo un positivo en serología tengo que tratar? patrocinado por Leisguard® de Ecuphar
Autoría: Anna Vila, LV, Dipl ECVIM, Servicio de Medicina Interna en Hospital Veterinario Universidad Católica de Valencia (UCV) y Xavier Roura, LV, PhD, Dipl ECVIM-CA, Hospital Clínic Veterinari Universitat Autònoma de Barcelona (UAB)
WhatsVet
Módulo: Cuando la leishmaniosis afecta a la funcionalidad renal patrocinado por Leisguard® de Ecuphar
Autoría: Anna Vila, LV, Dipl ECVIM, Servicio de Medicina Interna en Hospital Veterinario Universidad Católica de Valencia (UCV) y Xavier Roura, LV, PhD, Dipl ECVIM-CA, Hospital Clínic Veterinari Universitat Autònoma de Barcelona (UAB)
Podcasts
10 audiotips: ¿Qué hacemos con un paciente con leishmaniosis en el que diagnosticamos enfermedad renal? patrocinado por Leisguard® de Ecuphar
Autoría: Anna Vila, LV, Dipl ECVIM, Servicio de Medicina Interna en Hospital Veterinario Universidad Católica de Valencia (UCV) y Xavier Roura, LV, PhD, Dipl ECVIM-CA, Hospital Clínic Veterinari Universitat Autònoma de Barcelona (UAB)
Leisguard® de Ecuphar
Manejo terapéutico de la leishmaniosis desde el paciente seropositivo sano hasta aquel con enfermedad renal avanzada
Folleto Leisguard® - 10 años de experiencia
Conoce los resultados de más de una década de uso de Leisguard® en la prevención de la leishmaniosis canina. Datos clínicos reales, eficacia comprobada y su papel en programas preventivos en el arco mediterráneo.
Minidíptico Leispro® para Propietarios
Guía práctica para tutores de perros sobre cómo prevenir la leishmaniosis con el programa Leispro®. Información clara, sencilla y con garantía, ideal para acompañar la consulta veterinaria.
Post para Veterinarios – Programa Leispro®
Material visual para consulta o redes sociales. Explica de forma sintética los 3 pasos del programa preventivo Leispro® para proteger frente a la leishmaniosis: test, repelente y Leisguard®.
Folleto Leisguard®
Folleto informativo con los beneficios clave de Leisguard® como inmunomodulador. Ideal para explicar a clientes o en campañas de concienciación la importancia de su uso en zonas endémicas.
Anuncio Leisguard® para Seropositivos
Campaña gráfica enfocada en perros seropositivos sanos. Promueve el uso de Leisguard® como estrategia para evitar el desarrollo de la enfermedad clínica. Si quieres más información, consulta con tu delegado comercial de zona.
Cavalera et al. (2021) – Efecto de Leisguard® en Leishmaniosis y ERC
Estudio clínico que evalúa el impacto de domperidona en perros con leishmaniosis y enfermedad renal crónica. Resultados prometedores en marcadores inflamatorios y función renal.
Cavalera et al. (2022) – Domperidona + dieta renal
Ensayo clínico que demuestra cómo el uso combinado de Leisguard® y dieta renal puede ralentizar la progresión de la enfermedad renal crónica en perros con leishmaniosis.
Baxarias et al. (2023) – Leisguard® en perros seropositivos sanos
Ensayo clínico multicéntrico que avala la eficacia preventiva de Leisguard® en perros seropositivos asintomáticos. Menor progresión a enfermedad y excelente perfil de seguridad.
Formación WhatsApp
Microlearning vía WhatsApp
Módulo: Cuando la leishmaniosis afecta a la funcionalidad renal
Patrocinado por Leisguard® de Ecuphar

Anna Vila
LV, Dipl ECVIM, Servicio de Medicina Interna en Hospital Veterinario Universidad Católica de Valencia (UCV)

Xavier Roura
LV, PhD, Dipl ECVIM-CA, Hospital Clínic Veterinari Universitat Autònoma de Barcelona
Módulo: Cuando la leishmaniosis afecta a la funcionalidad renal
Parte 1


1.1
Haz clic en la imagen para obtener una vista más ampliada
¿Cómo afecta la Leishmania al riñón?
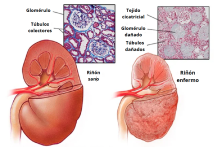
La enfermedad renal es la principal causa de muerte en perros con leishmaniosis, siendo su origen multifactorial. La glomerulonefritis inmunomediada es el principal mecanismo de daño, donde los inmunocomplejos circulantes se depositan en el glomérulo, desencadenando inflamación, alteración estructural y proteinuria persistente, un factor clave en la progresión a enfermedad renal crónica. Además, la inflamación crónica provoca lesión tubular e intersticial, con infiltración mononuclear y fibrosis progresiva.20 La proteinuria está presente en aproximadamente el 50 % de los perros con leishmaniosis, por lo que su evaluación es esencial en estos pacientes.21 Asimismo, la hipertensión sistémica, detectada en un 29-62 % de los casos, agrava la lesión glomerular y acelera la progresión de la nefropatía.21
Figura 1. Comparación macroscópica e histológica entre un riñón sano y un riñón enfermo. Imagen obtenida de la Fundación Mayo (Mayo Foundation for Medical Education).
1.2
Haz clic en la imagen para obtener una vista más ampliada
Glomerulonefritis y nefritis tubulointersiticial en Leishmania
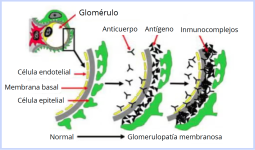
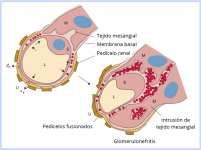
La glomerulonefritis inmunomediada es una lesión renal frecuente en perros con leishmaniosis, causada por la deposición de complejos inmunes circulantes (CIC) en los glomérulos. La estimulación antigénica persistente provoca inflamación y daño estructural.8 Histológicamente, se observan glomerulonefritis membranoproliferativa, mesangioproliferativa y membranosa.7,20 Clínicamente, los perros pueden desarrollar síndrome nefrótico, con proteinuria, hipoalbuminemia y edema.
Por otra parte, la nefritis tubulointersiticial, con infiltrados mononucleares, atrofia tubular y fibrosis intersticial, también es frecuente.20 Se asocia a citocinas proinflamatorias e inmunocomplejos en el intersticio renal (Wilson et al., 2017). Un estudio mostró que el 78 % de los perros con leishmaniosis presentaban nefritis intersticial, incluso sin síntomas clínicos.22
Figura 2. Esquema de la glomerulopatía membranosa. En condiciones normales, la barrera glomerular está intacta, mientras que en la glomerulopatía se observa la formación de inmunocomplejos (anticuerpo-antígeno) en la membrana basal glomerular, lo que provoca daño estructural y funcional.
1.3
Haz clic en la imagen para obtener una vista más ampliada
Proteinuria en perros con leishmaniosis
La proteinuria es un hallazgo común en perros con leishmaniosis y se asocia con daño glomerular. Se debe principalmente, a la alteración de la barrera de filtración glomerular por la deposición de inmunocomplejos y la inflamación resultante.7 La relación proteína/creatinina en orina (UPC) es el método más utilizado para cuantificar la proteinuria y evaluar la progresión de la enfermedad renal. Un valor superior a 0,5 en perros es indicativo de proteinuria patológica.8 Deberíamos cuantificar el UPC en todos los pacientes con Leishmania, porque la proteinuria persistente está vinculada a una progresión más rápida de la nefropatía y a un peor pronóstico.4
Figura 3. Orina de un paciente con leishmaniosis que presentaba disminución de la densidad urinaria, proteinuria y hematuria (se aprecia el depósito de glóbulos rojos tras la centrifugación de la muestra). Fuente: propia.
1.4
Haz clic en la imagen para obtener una vista más ampliada
Hipertensión sistémica y enfermedad renal
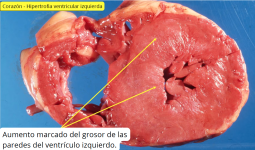
La hipertensión sistémica es una complicación frecuente en perros con leishmaniosis y agrava el daño renal. Se estima que el 29-62 % de los perros con leishmaniosis presentan hipertensión, lo que contribuye a la progresión de la glomerulopatía.21 El aumento de la presión intraglomerular exacerba la proteinuria y acelera la fibrosis renal. Además, la hipertensión mal controlada no solo acelera el daño renal, sino que también aumenta el riesgo de complicaciones cardiovasculares, como hipertrofia ventricular izquierda (HVI) y retinopatía hipertensiva. De hecho, en un estudio la HVI fue la consecuencia sistémica más común de la hipertensión, presente en el 91,4 % de los pacientes hipertensos con Leishmania. Los IECAs serían la primera opción terapéutica para el control hipertensivo.7
Figura 4. Hipertrofia ventricular izquierda marcada, complicación frecuente de la hipertensión. Fuente: Servicio de Histopatología de la Universidad de Singapur.

Módulo: Cuando la leishmaniosis afecta a la funcionalidad renal
Parte 2


2.1
Haz clic en la imagen para obtener una vista más ampliada
Biomarcadores para la detección temprana del daño renal
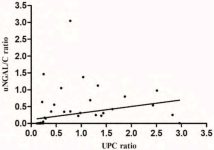
El diagnóstico precoz de la enfermedad renal en perros con leishmaniosis es un desafío, ya que los marcadores tradicionales como la creatinina y la urea sérica carecen de sensibilidad en fases iniciales. La dimetil arginina simétrica (SDMA) es un marcador más sensible de disfunción glomerular, ya que aumenta antes que la creatinina en la enfermedad renal. Otros biomarcadores urinarios, como la lipocalina asociada a gelatinasa de neutrófilos (NGAL), la N-acetil-β-D-glucosaminidasa (NAG) y otros varios que comentaremos próximamente, permiten identificar daño tubular precozmente.19,23 Además, la evaluación de la relación proteína:creatinina urinaria (UPC) sigue siendo fundamental para detectar proteinuria. La combinación de estos biomarcadores puede ayudar a mejorar la detección temprana del daño renal en perros con leishmaniosis.
Figura 5. Representación de los valores del ratio uNGAL/creatinina y del UPC, en la que se aprecia una clara correlación entre ambos.23
2.2
Haz clic en la imagen para obtener una vista más ampliada
Uso de domperidona en perros con leishmaniosis y enfermedad renal crónica
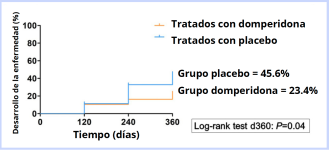
Un estudio reciente evaluó el efecto de la domperidona (Leisguard®) en perros con leishmaniosis y enfermedad renal crónica (ERC). Los resultados mostraron que la administración de domperidona produjo una reducción significativa en los títulos de anticuerpos contra Leishmania infantum, globulinas, gamma globulinas y proteína C reactiva (CRP). Además, se observó una disminución significativa en los niveles de creatinina sérica en algunos perros, lo que sugiere un efecto positivo sobre la función renal. Sin embargo, no hubo cambios significativos en la relación proteína/creatinina urinaria. Estos resultados preliminares indican que la domperidona podría mejorar tanto la respuesta inmune como la función renal en perros con leishmaniosis y ERC.36
Figura 6. Evolución de 111 perros seropositivos tratados con domperidona (n=67) frente a placebo (n=44) durante 360 días. A los 12 meses, el 23,4 % de los perros tratados con domperidona desarrollaron la enfermedad, en comparación con el 45,6 % del grupo placebo. La diferencia fue estadísticamente significativa. Fuente: Baxarias et al., 2023.
2.3
Haz clic en la imagen para obtener una vista más ampliada
Clasificación IRIS en Leishmania
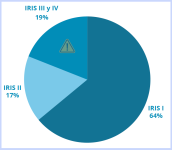
El sistema de clasificación IRIS divide a los pacientes en estadios según la función renal, con los grados más altos correlacionados con mayor proteinuria y daño estructural. Los perros con leishmaniosis pueden presentar distintos niveles de disfunción renal, por lo que esta clasificación es clave para su manejo. Un estudio de 2024 reportó que el 64 % de los perros con enfermedad renal y leishmaniosis estaban en IRIS I, un 17 % en IRIS II y el resto en IRIS III y IV (Ruiz et al., 2024). La proteinuria es un marcador clave, y un UPC >0,5 indica daño renal significativo. Sin embargo, valores entre 0,2 y 0,5 se consideran borderline, por lo que es esencial monitorizar regularmente el UPC para detectar progresiones tempranas.10
Figura 7. Representación del porcentaje de los distintos estadios IRIS en los pacientes con leishmaniosis.18
2.4
Haz clic en la imagen para obtener una vista más ampliada
¿Cuándo está indicado realizar una biopsia renal?
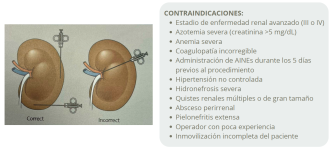
La biopsia renal está indicada, principalmente, cuando queremos descubrir si hay un componente inmunomediado participando en la enfermedad renal que podría beneficiarse de inmunosupresores. Por ello, la biopsia se recomienda en casos de proteinuria severa (UPC ≥ 3,5), enfermedad renal progresiva, sospecha de componente inmunomediado activo o cuando ya se esté considerando el uso de inmunosupresores. Además, permite diferenciar si la enfermedad renal es exclusiva de la leishmaniosis o si existen patologías concomitantes.7
Sin embargo, no se recomienda en enfermedad renal avanzada (IRIS III-IV), coagulopatías, quistes renales o hipertensión no controlada. Además, para un análisis adecuado, se requiere acceso a microscopía electrónica e inmunofluorescencia, ya que el análisis con microscopía óptica puede ser insuficiente en hasta el 27 % de los casos.7
Figura 8. Representación visual del método correcto e incorrecto de biopsiar el riñón, junto a las contraindicaciones del procedimiento. La aguja debería mantenerse en la corteza renal, preferiblemente en el polo caudal o craneal. No debería cruzar la unión corticomedular ni la médula o pelvis renal. Fuente: BSAVA Manual de Nefrología y Urología, 2017.

Módulo: Cuando la leishmaniosis afecta a la funcionalidad renal
Parte 3


3.1
Haz clic en la imagen para obtener una vista más ampliada
Tratamiento de la proteinuria en perros con leishmaniosis
El manejo de la proteinuria en leishmaniosis depende del estado clínico del paciente. En perros con UPC ≤ 3,0, se recomienda iniciar la terapia leishmanicida y evaluar la respuesta tras la misma. Si la proteinuria persiste, se introduce una dieta renal, un tratamiento antiproteinúrico como ARA II / telmisartan / losartan) o IECAs (enalapril / benazepril)). Si la proteinuria es severa (UPC > 3,0), la terapia leishmanicida y antiproteinúrica se administran simultáneamente. Se recomienda dieta renal baja en fósforo y ácidos grasos omega-3, con revaloraciones cada 4 semanas.7 Es importante recordar que cuando utilizamos IECAs, especialmente si los asociamos con ARA II, debemos monitorizar frecuentemente la presión arterial y los niveles de potasio.
Figura 9. Evaluación de la proteinuria mediante tira reactiva en orina. Aunque es útil como prueba orientativa, la tira de orina no es suficiente para cuantificar la proteinuria, siendo necesaria la medición de la relación proteína/creatinina urinaria (UPC) para una valoración precisa.
3.2
Haz clic en la imagen para obtener una vista más ampliada
Terapia antihipertensiva en perros con leishmaniosis y enfermedad renal
Como ya hemos explicado, la prevalencia de la hipertensión en leishmaniosis canina es verdaderamente alta (29-62 %). Siempre tendremos que medir la presión arterial en los pacientes y tratarla si la presión sistólica supera los 160 mmHg de forma persistente en el tiempo, debido al riesgo de daño renal progresivo. Los IECA son la primera opción en perros con hipertensión leve a moderada. En casos más graves, puede utilizarse un bloqueante de los canales de calcio, como el amlodipino y combinarse con bloqueadores de los receptores de angiotensina (ARA II), como telmisartán o losartán siempre que el paciente no presente un fallo renal agudo.
Si el paciente presenta señales de daño en órganos diana, comenzaremos con los hipertensivos pese a que no se haya podido demostrar la hipertensión persistente.7, 10
Figura 10. Paciente que ha sufrido un desprendimiento de retina debido a la hipertensión. Fuente: Clinician´s Brief.
3.3
Haz clic en la imagen para obtener una vista más ampliada
Dieta renal y domperidona ¿todos los perros necesitan dieta renal?
Figura 11. Perro frente a un bol de comida. La elección de la dieta en perros con leishmaniosis debe individualizarse: mientras que una dieta estándar puede ser adecuada en fases tempranas sin proteinuria, las dietas renales son recomendables en casos de enfermedad renal crónica avanzada.
3.4
Haz clic en la imagen para obtener una vista más ampliada
El antimoniato de meglumina, ¿se considera nefrotóxico?
Se ha considerado el antimoniato de meglumina como un tratamiento potencialmente nefrotoxico en la leishmaniosis canina. No obstante, este concepto ha cambiado y se considera que el aumento de la azotemia o proteinuria en algunos perros tratados con antimoniales, se debe probablemente a la formación y depósito renal de inmunocomplejos que ocurre tras el comienzo del tratamiento con el fármaco. Por ello, el tratamiento combinado con antimoniales de meglumina alopurinoles es el más utilizado. Sin embargo, es crucial una monitorización continua de los parámetros renales tras el comienzo del tratamiento para corroborar que el paciente no desarrolla un empeoramiento de la enfermedad renal.
Figura 12. Paciente que sufre un fallo renal agudo tras el comienzo del tratamiento con antimoniato de meglumine, pero que finalmente pudo continuar con la terapia tras unos días de hospitalización. Fuente: propia.

Módulo: Cuando la leishmaniosis afecta a la funcionalidad renal
Parte 4


4.1
Haz clic en la imagen para obtener una vista más ampliada
Tratamiento de la proteinuria en perros con leishmaniosis
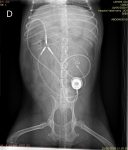
El alopurinol, aunque es parte del tratamiento contra la leishmaniosis, conlleva riesgos como xantinuria y resistencia farmacológica. La formación de cristales de xantina puede ocurrir desde las tres semanas hasta años después de iniciar el tratamiento. Las alteraciones urinarias (xantinuria, urolitiasis y/o mineralización renal) son frecuentes. Estos cristales no se disuelven con tratamiento médico y pueden dañar el riñón. Por ello, se recomienda monitorización desde el inicio mediante urianálisis y estudios de imagen cada 1-3 meses para detectar complicaciones. Además, se aconseja mantener el alopurinol solo durante los primeros 12 meses en la mayoría de los casos, sustituyéndolo a largo plazo por estrategias con menos efectos adversos, como el uso profiláctico de domperidona.38
Figura 13. Radiografía de un paciente al que debimos implantarle un dispositivo SUB tras el desarrollo de cálculos de xantina, como efecto secundario del tratamiento prolongado con alopurinol. Fuente: propia.
4.2
Haz clic en la imagen para obtener una vista más ampliada
¿Qué efectos adversos tiene el alopurinol y que puedo hacer?
La xantinuria es un efecto adverso significativo en perros tratados a largo plazo con alopurinol, detectado por el 71,6 % de los veterinarios. En un estudio reciente se estimó que uno de cada cuatro perros tratados presentaba una xantinuria significativa. Cuando esto ocurre en alguno de nuestros pacientes hay varias opciones que se puede considerar como disminuir la dosis a 10 mg/kg/c 24h, discontinuar el alopurinol, utilizar una dieta baja en purinas. En perros con efectos adversos persistentes, también puede considerarse el uso de inmunomoduladores como la domperidona para mitigar la progresión de la enfermedad.
Figura 14. Imagen microscópica de cristales de xantina en orina (xantinuria), que se pueden formar a causa del tratamiento con alopurinol. Fuente: Osborne et al., 2009.
4.3
Haz clic en la imagen para obtener una vista más ampliada
¿Qué hago frente a un empeoramiento renal tras empezar el tratamiento?
Al comenzar el tratamiento con antimoniato de meglumina o miltefosina y alopurinol, es clave monitorizar al paciente y su función renal. Si los valores se mantienen, continuamos el tratamiento. Sin embargo, si aumentan, podemos reducir la dosis del leishmanicida o incluso suspenderlo temporalmente. Además, se puede considerar el uso de prednisona, con control de creatinina y UPC en 3-7 días7 o el uso de terapias de remplazo renal. Esto se debe a que el inicio del tratamiento leishmanicida puede provocar un aumento en la presencia de antígenos en sangre e inducir a la formación y depósito de inmunocomplejos en los riñones, membrana sinovial, úvea, etc. Por lo que requiere seguimiento estrecho para evitar un mayor daño renal y otras complicaciones asociadas a esta inmunodeposición.7
Figura 15. Esquematización del proceso de inmunodeposición que ocurre en el glomérulo. Fuente: Actor, J.K. (2014)
4.4
Haz clic en la imagen para obtener una vista más ampliada
Cambios ecográficos en enfermedad renal por Leishmania
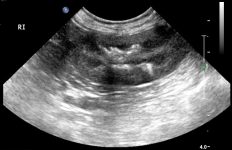
La ecografía abdominal es una herramienta clave en perros con leishmaniosis, ya que permite detectar alteraciones estructurales asociadas a la enfermedad renal incluso antes de que aparezca la azotemia. Las principales alteraciones incluyen aumento de la ecogenicidad cortical, hepatomegalia y esplenomegalia. También es frecuente la disminución de la diferenciación corticomedular del riñón. A menudo se observa linfadenomegalia abdominal, afectando principalmente a los linfonodos ilíacos y mesentéricos. En casos avanzados, pueden encontrarse riñones pequeños y con contornos irregulares, compatibles con enfermedad renal crónica.29 Los hallazgos ecográficos deben interpretarse junto con los signos clínicos y los datos laboratoriales para un correcto abordaje del paciente.
Figura 16. Visualización ecográfica de un riñón con enfermedad renal crónica, en un paciente con leishmaniosis. La paciente mostraba una moderada pérdida de diferenciación corticomedular renal bilateral. Fuente: Servicio de Imagen del Hospital Veterinario UCV.

Módulo: Cuando la leishmaniosis afecta a la funcionalidad renal
Parte 5


5.1
Haz clic en la imagen para obtener una vista más ampliada
Alteraciones en el metabolismo del fósforo en perros con leishmaniosis y enfermedad renal
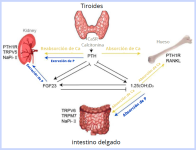
La hiperfosfatemia es común en perros con leishmaniosis y enfermedad renal crónica (ERC). La disminución de la excreción urinaria de fósforo, asociada a la disminución de la tasa de filtración glomerular, es la causa más común de hiperfosfatemia. Este desequilibrio puede conducir a hiperparatiroidismo secundario renal, empeorando el daño óseo y promoviendo la calcificación de tejidos blandos. Además, la hiperfosfatemia se ha relacionado con un aumento de la morbilidad y mortalidad en perros con enfermedad renal crónica.30 Por ello, es esencial monitorizar los niveles de fósforo en perros con leishmaniosis y ERC, implementando estrategias dietéticas y terapéuticas para controlar estos niveles y mejorar así el pronóstico del paciente.
Figura 17. Regulación del metabolismo del calcio y fósforo. La disminución de la excreción renal de fósforo en perros con leishmaniosis y enfermedad renal crónica puede inducir hiperfosfatemia, estimulando la liberación de PTH y FGF23 y la creación de un hiperparatiroidismo secundario. Fuente: Sun, M. et al. (2020)
5.2
Haz clic en la imagen para obtener una vista más ampliada
Factores de recaída en perros con leishmaniosis y enfermedad renal
Las recaídas en perros con leishmaniosis son frecuentes y representan un desafío clínico. Un estudio reciente analizó los factores de riesgo asociados a recaídas que requieren tratamiento leishmanicida, identificando que un bajo cociente albúmina/globulina (A/G) y una puntuación clínica elevada (CS) aumentan significativamente el riesgo de recaída.8
Por cada aumento de 0,1 en el A/G, las probabilidades de necesitar tratamiento disminuyen un 45 %, mientras que por cada punto adicional en la puntuación clínica, el riesgo de recaída sube entre un 22 y 30 %. Además, la hipoalbuminemia, anemia e hiperglobulinemia beta fueron factores clave en la recurrencia.
Estos hallazgos refuerzan la necesidad de un seguimiento clínico regular, prestando atención al proteinograma, hematocrito y puntuación clínica para ajustar el tratamiento a tiempo.
Figura 18. Resultado del estudio de la bibliografía 8, en el que se analizaban los factores de riesgo de las recaídas en pacientes con leishmaniosis, siendo los principales el ratio A/G bajo, la hipoalbuminemia, la hiperbetaglobulinemia, la anemia y títulos elevados en serología.
5.3
Haz clic en la imagen para obtener una vista más ampliada
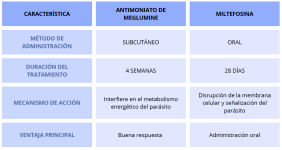
Antimoniato de meglumina vs. miltefosina
El antimoniato de meglumina sigue siendo el tratamiento de elección para la leishmaniosis canina por su mayor eficacia en la reducción de la carga parasitaria y mejor respuesta clínica. Un estudio reciente mostró que el 91,9 % de los perros tratados presentaron mejoría clínica a los 180 días, con negativización de PCR en médula ósea en el 78,5 % de los casos.32, 34 Sin embargo, puede causar efectos adversos en 30 % de los perros, como reacciones en el sitio de inyección, vómitos y, en menor medida, pancreatitis.32
Por otro lado, miltefosina es una alternativa en perros donde las inyecciones son un problema. Su administración oral mejora la adherencia al tratamiento y reduce significativamente la carga parasitaria y la infectividad a los flebótomos.33
Figura 19. Comparación entre distintas características de los dos leishmanicidas más utilizados para la leishmaniosis: el antimoniato de meglumine y la miltefosina. Fuente: propia.
5.4
Haz clic en la imagen para obtener una vista más ampliada
Pronóstico del paciente renal con leishmaniosis
El pronóstico en perros con leishmaniosis y enfermedad renal varía según el grado de afectación renal y la respuesta al tratamiento. Tradicionalmente, se consideraba una condición de mal pronóstico, pero con diagnósticos más tempranos y mejores tratamientos, la supervivencia ha mejorado.
Perros en estadios IRIS I y II, o IRIS III temprano, pueden tener un pronóstico favorable a reservado si reciben terapia adecuada. En cambio, aquellos con IRIS III avanzado o IRIS IV tienen un pronóstico reservado a grave, especialmente si presentan proteinuria progresiva.
La monitorización de la proteinuria tras el tratamiento leishmanicida es clave para evaluar el pronóstico, ya que su persistencia se asocia con peor evolución.
Figura 20. Paciente tratado de leishmaniosis con enfermedad renal IRIS I y pronóstico favorable. Fuente: propia.
Bibliografía
- Sykes, J.E. et al. (2023) Greene’s Infectious Diseases of the dog and cat. St. Louis, MO: Elsevier.
- Gálvez, R. et al. (2020) ‘Latest trends in Leishmania infantum infection in dogs in Spain, part I: Mapped Seroprevalence and sand fly distributions’, Parasites & Vectors, 13(1). doi:10.1186/s13071-020-04081-7.
- Moreno, J. and Alvar, J. (2002) ‘Canine leishmaniasis: Epidemiological risk and the experimental model’, Trends in Parasitology, 18(9), pp. 399– doi:10.1016/s1471-4922(02)02347-4.
- Solano-Gallego, L. et al. (2011) ‘LEISHVET guidelines for the practical management of canine leishmaniosis’, Parasites & Vectors, 4(1). doi:10.1186/1756-3305-4-86.
- Roura, X. et al. (2013) ‘Prognosis and monitoring of leishmaniasis in dogs: A Working Group report’, The Veterinary Journal, 198(1), pp. 43– doi:10.1016/j.tvjl.2013.04.001.
- Paltrinieri, S. et al. (2010) ‘Guidelines for diagnosis and clinical classification of leishmaniasis in dogs’, Journal of the American Veterinary Medical Association, 236(11), pp. 1184– doi:10.2460/javma.236.11.1184.
- Roura, X. et al. (2020) ‘Canine leishmaniosis and kidney disease: Q&A for an overall management in clinical practice’, Journal of Small Animal Practice, 62(1). doi:10.1111/jsap.13237.
- Sarquis, J. et al. (2024) ‘Clinical validation of circulating immune complexes for use as a diagnostic marker of canine leishmaniosis’, Frontiers in Veterinary Science, 11. doi:10.3389/fvets.2024.1368929.
- Miró, G. et al. (2024) ‘New immunomodulatory treatment protocol for canine LEISHMANIOSIS reduces parasitemia and proteinuria’, PLOS Neglected Tropical Diseases, 18(12). doi:10.1371/journal.pntd.0012712.
- Iris guidelines (2023) IRIS. Available at: https://www.iris-kidney.com/iris-guidelines-1
- Ben Slimane, T. et al. (2014) ‘An investigation on vertical transmission of Leishmania infantum in experimentally infected dogs and assessment of offspring’s infectiousness potential by xenodiagnosis’, Veterinary Parasitology, 206(3–4), pp. 282– doi:10.1016/j.vetpar.2014.10.020.
- Silva, F.L. et al. (2009) ‘Venereal transmission of canine visceral leishmaniasis’, Veterinary Parasitology, 160(1–2), pp. 55– doi:10.1016/j.vetpar.2008.10.079.
- Dantas-Torres, F. (2011) ‘Ticks as vectors of Leishmania parasites’, Trends in Parasitology, 27(4), pp. 155– doi:10.1016/j.pt.2010.12.006.
- Naucke, T.J., Amelung, S. and Lorentz, S. (2016) ‘First report of transmission of canine leishmaniosis through bite wounds from a naturally infected dog in Germany’, Parasites & Vectors, 9(1). doi:10.1186/s13071-016-1551-0.
- Nabity, M.B. (2018) ‘Traditional renal biomarkers and new approaches to diagnostics’,
- Toxicologic Pathology, 46(8), pp. 999–1001. doi:10.1177/0192623318800709.
- Ruiz, P. et al. (2024) Urinary neutrophil gelatinase-associated lipocalin as early biomarker for renal disease in dogs with leishmaniosis [Preprint]. doi:10.2139/ssrn.4757995.
- Ruiz, P. et al. (2023) ‘Urinary cystatin C and N-acetyl-beta-D-glucosaminidase (NAG) as early biomarkers for renal disease in dogs with leishmaniosis’, Veterinary Parasitology, 318, p. 109930. doi:10.1016/j.vetpar.2023.109930.
- Pantaleo, V. et al. (2024) ‘Short term treatment monitoring of renal and inflammatory biomarkers with naturally occurring leishmaniosis: A cohort study of 30 dogs’, Veterinary Sciences, 11(11), p. 517. doi:10.3390/vetsci11110517.
- Aresu, L. et al. (2012) ‘Light and electron microscopic analysis of consecutive renal biopsy specimens from leishmania-seropositive dogs’, Veterinary Pathology, 50(5), pp. 753– doi:10.1177/0300985812459336.
- Cortadellas, O. et al. (2006) ‘Systemic hypertension in dogs with leishmaniasis: Prevalence and clinical consequences’, Journal of Veterinary Internal Medicine, 20(4), p. 941. doi:10.1892/0891-6640(2006)20[941:shidwl]2.0.co;2.
- Costa, F.A. et al. (2003) ‘Histopathologic patterns of nephropathy in naturally acquired canine visceral leishmaniasis’, Veterinary Pathology, 40(6), pp. 677– doi:10.1354/vp.40-6-677.
- Peris, M.P. et al. (2020) ‘Neutrophil gelatinase-associated lipocalin (NGAL) is related with the proteinuria degree and the microscopic kidney findings in Leishmania-infected dogs’, Microorganisms, 8(12), p. 1966. doi:10.3390/microorganisms8121966.
- López, M.C. et al. (2022) ‘Chronic diarrhea secondary to canine leishmaniosis: Case series’, Comparative Immunology, Microbiology and Infectious Diseases, 90–91, p. 101897. doi:10.1016/j.cimid.2022.101897.
- Santos, B.G. et al. (2021) ‘Focal myositis associated with Leishmania spp. infection in a dog – diagnostic approach’, Ciência Rural, 51(2). doi:10.1590/0103-8478cr20200247.
- Vamvakidis, C.D. et al. (2000) ‘Masticatory and skeletal muscle myositis in canine leishmaniasis (leishmania infantum)’, Veterinary Record, 146(24), pp. 698– doi:10.1136/vr.146.24.698.
- Sbrana, S. et al. (2014) ‘Retrospective study of 14 cases of canine arthritis secondary to leishmania infection’, Journal of Small Animal Practice, 55(6), pp. 309– doi:10.1111/jsap.12204.
- Zdora, I. et al. (2022) ‘Case report: Lympho-histiocytic meningoencephalitis with central nervous system vasculitis of unknown origin in three dogs’, Frontiers in Veterinary Science, 9. doi:10.3389/fvets.2022.944867.
- Camoletto, D.A. et al. (2020) ‘Alteraciones Ecográficas y hematológicas en caninos con leishmaniosis visceral’, Revista Veterinaria, 31(1), pp. 57–60. doi:10.30972/vet.3114632.
- Lucero, M. et al. (2019) `A plasma calcium-phosphorus product can be used to predict the lifespan of dogs with chronic kidney disease´, Can Vet Journal, PMC6855231
- Sarquis, J., et al. (2024). `Relapses in canine leishmaniosis: risk factors identified through mixed-effects logistic regression.´ Parasites & Vectors, 17(1), 64. https://doi.org/10.1186/s13071-024-06423-1
- Digiaro, S., et al. (2024) ‘Treatment of canine leishmaniasis with meglumine antimoniate: a clinical study of tolerability and efficacy’, Animals, 14(15), p. 2244. doi: 10.3390/ani14152244
- Nogueira, F.S. et al. (2019) ‘Use of miltefosine to treat canine visceral leishmaniasis caused by Leishmania infantum in Brazil’, Parasites & Vectors, 12(1), p. 79. doi: 10.1186/s13071-019-3323-0. ResearchGate+2https://oalib.com+2PubMed+2
- García, M. et al. (2024) ‘Critically Appraised Topic on Canine Leishmaniosis: Does Treatment with Antimonials and Allopurinol Have the Same Clinical and Clinicopathological Efficacy as Treatment with Miltefosine and Allopurinol, after One Month of Treatment?’, Veterinary Sciences, 11(6), p. 231. doi: 10.3390/vetsci11060231.
- Vila A, Movilla R, Lloret A, Majó N, Marco AJ, et al. (2016) Chronic Small Bowel Diarrhea Due to Granulomatous Duodenitis by Leishmania in two Dogs. J Vet Med Res 3(1): 1040
- Cavalera MA, Gernone F, Uva A, Donghia R, Zizzadoro C, Zatelli A. Efficacy of domperidone plus renal diet in slowing the progression of chronic kidney disease in dogs with leishmaniosis. Parasit Vectors. 2022 Oct 31;15(1):397. doi: 10.1186/s13071-022-05537-8. PMID: 36316751; PMCID: PMC9620618.
- Jesus L, Arenas C, Domínguez-Ruiz M, Silvestrini P, Englar RE, Roura X, Leal RO. Xanthinuria secondary to allopurinol treatment in dogs with leishmaniosis: Current perspectives of the Iberian veterinary community. Comp Immunol Microbiol Infect Dis. 2022 Apr;83:101783. doi: 10.1016/j.cimid.2022.101783. Epub 2022 Feb 24. PMID: 35240487.
- Torres M, Pastor J, Roura X, Tabar MD, Espada Y, Font A, Balasch J, Planellas M. Adverse urinary effects of allopurinol in dogs with leishmaniasis. J Small Anim Pract. 2016 Jun;57(6):299-304. doi: 10.1111/jsap.12484. Epub 2016 Apr 26. PMID: 27112522.
Sigue formándote con "Aprende a prevenir y tratar la enfermedad periodontal y conoce todas sus posibles afectaciones sistémicas" de la mano de Dental.pet by Ecuphar


WhatsVet | La salud bucodental como parte fundamental de un plan de medicina preventiva en la clínica diaria
Autoría: Ignacio Velázquez, Ldo. Vet. Dipl. AVDC. Dipl. EVDC, Board Certified Veterinary DentistTM, EBVS® European Veterinary, Specialist in Dentistry.
Podcast | 10 Audiotips: Tips con los que mejorar la inclusión de la salud bucodental en nuestro plan de medicina preventiva
Autoría: Ignacio Velázquez, Ldo. Vet. Dipl. AVDC. Dipl. EVDC, Board Certified Veterinary DentistTM, EBVS® European Veterinary, Specialist in Dentistry.
WhatsVet | Módulo: Opciones profilácticas y terapéuticas para el mantenimiento de una adecuada salud bucodental
Autoría: Ignacio Velázquez, Ldo. Vet. Dipl. AVDC. Dipl. EVDC, Board Certified Veterinary DentistTM, EBVS® European Veterinary, Specialist in Dentistry.
Podcast | 11 Audiotips: Tips para el manejo de la enfermedad periodontal ya instaurada… cuando la medicina preventiva no ha sido suficiente
Autoría: Ignacio Velázquez, Ldo. Vet. Dipl. AVDC. Dipl. EVDC, Board Certified Veterinary DentistTM, EBVS® European Veterinary, Specialist in Dentistry.